Trials
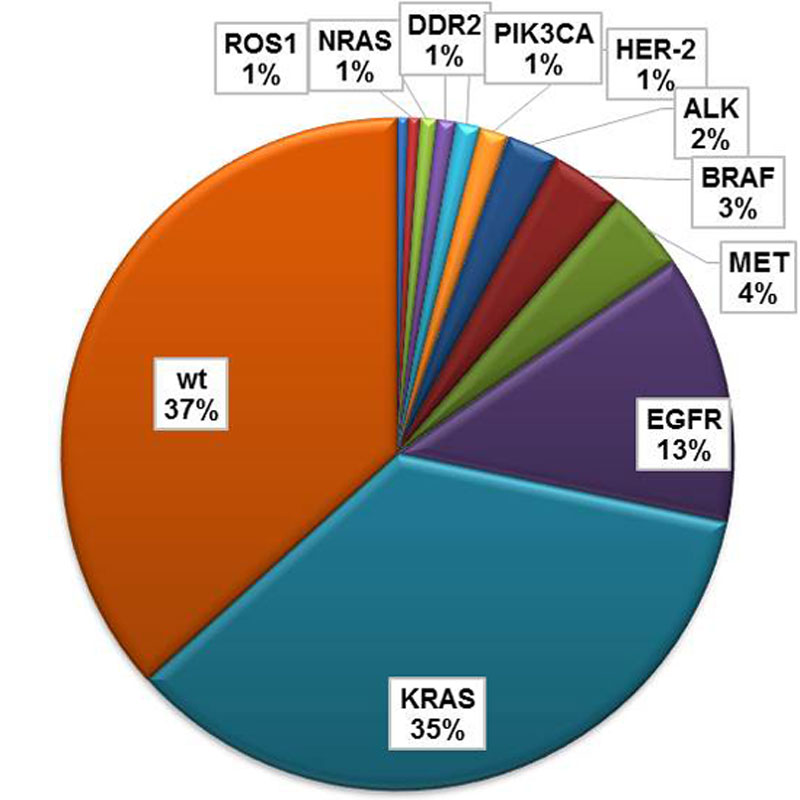
A primary goal of our clinical trial program is to provide every patient, who has a proven mutation in his tumor, with a customized therapy. This is possible for approx. 25% of patients with adenocarcinoma, for the squamous-cell carcinoma and the small cell lung cancer no therapeutically relevant mutations have been identified yet.
Chromosomale Translokationen, die das ALK (anaplastic large cell lymphoma receptor tyrosine kinase) Gen betreffen, führen zu dessen dauerhaften Aktivierung und somit zu einem Wachstum von Tumorezellen. Das Partnergen der hieraus resultierenden Fusion ist meistens das EML4-Gen. Die Fusion mit anderen Genen wird seltener beobachtet. ALK Translokationen schließen sich mit EGFR- und KRAS-Mutation in aller Regel aus. Das bedeutet, dass die genetischen Veränderungen nicht gleichzeitig vorliegen. Dieser genetische Defekt tritt mit einer Häufigkeit von ca. 3-5% der Patienten mit Adenokarzinomen auf – in der Regel bei Patienten jungen Alters, die nie geraucht haben. Histologisch zeigen diese Tumoren häufig ein azinäres oder siegelringartiges Wachstumsmuster. Aktuell ist der ALK-Inhibitor Crizotinib (Xalkori) für die Therapie dieser Tumoren in der 2.-Therapielinie zugelassen. Die Ansprechrate, also der Anteil der Patienten, bei denen der Tumor unter Therapie kleiner wird liegt bei etwa 70%. Leider hält der Erfolg in der Regel nur etwa 1 bis 2 Jahre an. Die Tumoren entwickeln eine sogenannte Resistenz. ALK-Inhibitoren der neuen Generation befinden sich aktuell in klinischer Erprobung und werden in Kürze zugelassen. Hierzu zählen die Medikamente Alectinib und Ceritinib.
Mutationen im BRAF-Gen finden sich in bis zu 2-5% der Bronchialkarzinome. Mit etwa 80% am häufigsten ist hierbei der Austausch einer Glutaminsäure durch Valin an der Position 600. Die hieraus entstehende Veränderung führt zu einer Aktivierung der Funktion der Proteins und heißt in der Fachsprache BRAFV600E. Seltener sind inaktivierende Mutationen im BRAF-Gen. Diese können an verschiedenen Stellen des Gens vorkommen – z.B. BRAFG466V oder BRAFY472CObwohl das gleiche Gen betroffen ist, haben die verschiedenen Mutationen entweder eine aktivierende oder eine hemmende Auswirkung auf das Protein. Dennoch tragen beide Arten zum Wachstum und somit zu den bösartigen Eigenschaften des Tumors bei. Für die Therapie des BRAFV600E-mutierten Lungenkrebses gibt es zur Zeit noch kein zugelassenen Medikament. Allerdings stehen zwei Medikamente, die für die Therapie des schwarzen Hautkrebses zugelassen sind im Rahmen von klinischen Studien oder Einzelfallbehandlungen zur Verfügung – Vemurafenib(Zelboraf) und Dabrafenib (Tafinlar). Wie gut die Wirkung dieser Medikamente auf den Lungenkrebs genau ist muss sich erst noch in Studien zeigen.
Mutationen im Gen DDR2 sind selten und kommen mit einer Frequenz von ca. 4% vor. In Versuchen im Labor konnte gezeigt werden, dass Veränderungen im DDR2-Gen das Wachstum von Tumoren fördern. Da das DDR2-Gen ausgesprochen lang ist, sind Mutationen an den verschiedensten Stellen gefunden worden. Die Bedeutung der meisten dieser Mutationen im Lungenkrebs ist bis heute nicht abschließend geklärt. Mutationen im DDR2-Gen können in der Parallelsequenzierung identifiziert werden. Leider gibt es für diese genetischen Veränderungen noch kein zielgerichtetes Medikament, welches uneingeschränkt empfohlen werden kann. Einzelfallberichte lassen allerdings eine Wirkung des Wirkstoffes Dasatinib vermuten. Ob eine Therapie mit diesem Medikament bei Ihnen sinnvoll ist, muss individuell erwogen werden. Hierzu nehmen Sie bitte Kontakt zu Ihrem behandelnden Arzt auf.
Mutationen im EGFR-Gen können bei etwa 10-15% der Patienten mit Adenokarzinomen der Lunge nachgewiesen werden. In den meisten Fällen sind Patienten betroffen die nie oder nur sehr wenig geraucht haben. Für die Erkrankung an einem EGFR-mutierten Lungenkrebs konnten bis heute keine Risikofaktoren identifiziert werden. Mutationen im EGFR-Gen sind starke onkogene Treiber. Das bedeutet, sie sind alleine in der Lage das ungehemmte Wachstum von Tumorzellen zu provozieren. Am häufigsten finden sich Mutationen in den Exonen 19 und 21 des EGFR-Gens – zusammen etwa 80%. Daneben lassen sich allerdings auch Mutationen in den Exonen 18 und 20 nachweisen. Die zielgerichtete Therapie des EGFR-mutierten Adenokarzinoms der Lunge ist eine Erfolgsgeschichte – die Medikamente Erlotinib (Tarceva) und Gefitinib (Iressa) schon viele Jahre für die Therapie zugelassen. Allerdings wirken EGFR-Inhibitoren nicht bei allen Mutationen des EGFR-Gens. So wirken die Medikamente bei Nachweis einer Mutation in den Exonen 18 und 20 nur sehr schlecht oder gar nicht. Ein weiteres Problem der Therapie mit allen der heute zugelassenen Tabletten – Erlotinib (Tarceva), Iressa (Gefitinib) oder Afatinib (Giotrif) – ist auch die begrenzte Wirkdauer. So entwickeln die meisten Tumoren nach 1-2 Jahren der Therapie eine Resistenz – die Tabletten verlieren ihre Wirkung. In den letzten Jahren konnte eine Reihe von Resistenzmechanismen identifiziert werden. Hierzu zählen unter anderem die erworbene Mutation T790M in Exon 20 des EGFR-Gens (EGFRT790M) sowie die Amplifikation des MET- oder des HER2-Gens. Welcher Mechanismus der Resistenz vorliegt und welche Therapiemöglichkeiten sich daraus ergeben ist nur durch die Analyse von frisch entnommenem Tumorgewebe möglich. In klinischen Studien werden Medikamente oder Medikamentenkombinationen getestet die die Resistenz brechen, die Entwicklung einer Resistenz verzögern oder im Falle des Vorliegens mehrerer Resistenzmechanismen den Tumor bekämpfen sollen. Bei Fragen hierzu wenden Sie sich bitte an Ihren behandelnden Arzt oder direkt an uns.
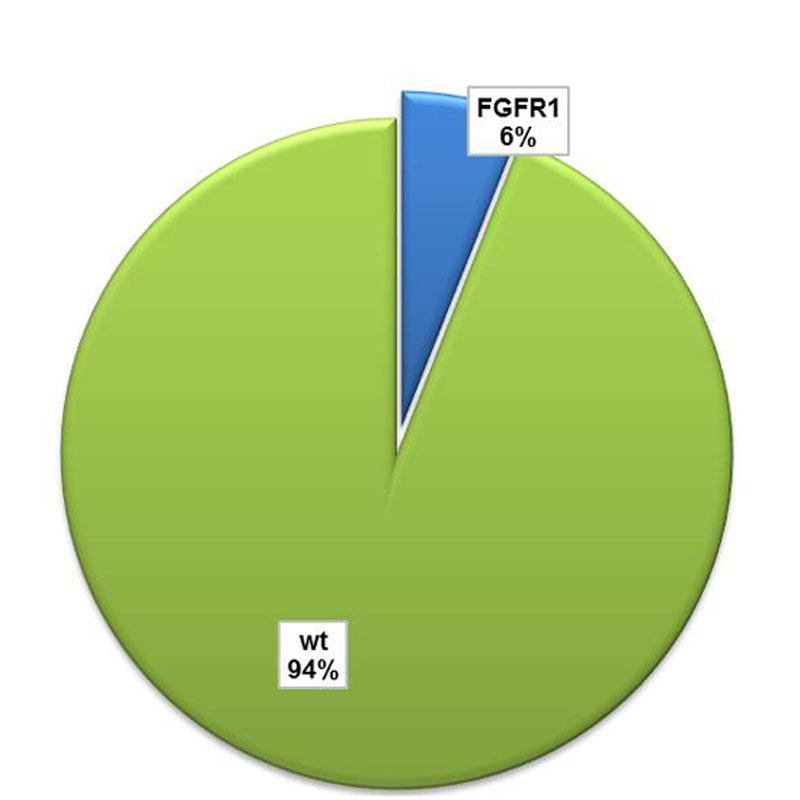
Amplifikationen, also Vervielfältigungen des Gens FGFR1 finden sich in ca. 15-20% der Plattenepithelkarzinome der Lunge. In Versuchen im Labor hat sich gezeigt, dass Veränderungen im FGFR1-Gen das Wachstum von Tumoren fördern. Leider gibt es für diese Patienten deren Tumoren diese genetische Veränderung aufweisen noch kein zugelassenes zielgerichtetes Medikament. Amplifikationen des FGFR1-Gens können mittels Fluoreszenz in-situ Hybridisierung detektiert werden. Dieser Test wird allerdings nur in Plattenepithelkarzinomen durchgeführt. Die Möglichkeit einer Therapie mit einem zielgerichteten Medikament ist zur Zeit nur im Rahmen von klinischen Medikamentenstudien möglich. Bei Fragen hierzu wenden Sie sich bitte an Ihren behandelnden Arzt oder direkt an uns.
Im Gen HER2, auch ERBB2 genannt, können zwei verschiedene genetische Veränderungen gefunden werden – HER2/ERBB2-Amplifikationen und HER2/ERBB2-Mutationen. Diese Veränderungen sind mit 2-5% selten. Amplifikationen und Mutationen des HER2 sind bekannte onkogene Treiber, können also alleine das Wachstum von bösartigen Tumoren fördern. Erworbene Amplifikationen des HER2-Gens spielen außerdem in der Entwicklung von Resistenzen auf die Therapie mit EGFR-Inhibitoren bei Patienten mit EGFR-mutierten Adenokarzinomen eine wichtige Rolle und stellen einen potentiellen Therapieansatz im Resistenzfall dar (siehe EGFR). Amplifikationen des HER2-Gens können mittels Fluoreszenz in-situ Hybridisierung detektiert werden. Nach Mutationen des Gens, wird in der Parallelsequenzierung gesucht. Anders als im Magen- und Brustkrebs, ist eine zielgerichtete Therapie im HER2-positiven Lungenkrebs noch nicht zugelassen worden. Allerdings werden in klinischen Studien Therapieansätze getestet, die gezielt die onkogene Wirkung des Proteins hemmen sollen. Eine experimentelle Therapie mit für den Magen- und Brustkrebs zugelassenen Medikamenten außerhalb von Studien, kann nicht uneingeschränkt empfohlen werden. Bitte wenden Sie sich bei Fragen an Ihren behandelnden Arzt oder direkt an uns.
Aktivierende Mutationen im KRAS-Gen sind mit 25% die häufigsten genetischen Veränderungen die zum Wachstum von Lungenkrebs führen überhaupt. KRAS-Mutationen kommen in der Regel nur Adenokarzinomen vor, in erster Linie in Rauchern oder ehemaligen Rauchern. Mutationen im KRAS-Gen können mittels Parallelsequenzierung nachgewiesen werden. Obwohl Mutationen im KRAS-Gen als Ursache für das Wachstum von Tumoren schon sehr lange bekannt sind konnte bis heute keine zielgerichtete Therapie zugelassen werden. Verantwortlich hierfür sind die komplexe Struktur des KRAS-Proteins sowie der äußerst dynamische Wachstumsmechanismus der durch die Aktivierung in Tumorzellen ausgelöst wird. Eine Reihe von zielgerichteten Therapieansätzen wird allerdings im Rahmen von Studie überprüft. Wenn Sie Fragen hierzu haben, wenden Sie sich bitte an Ihren behandelnden Arzt oder direkt an uns.
Genetische Veränderungen im MET-Gen sind heterogen. So kommen sowohl Mutationen als auch Amplifikationen vor. Nicht alle Veränderungen die im MET-Gen gesichert werden können haben auch eine Auswirkung auf das Wachstum von Tumorzellen. Die häufige Veränderung METT1010I zum Beispiel ist eine Normvariante und hat somit keine Therapierelevanz. Die Bedeutung der ebenfalls häufig vorkommende niedrig-schwelligen Amplifikation von MET (MET low-level Amplifikation) konnte nicht abschließend geklärt werden und eignet sich nach heutigem Stand nicht als Ziel einer Therapie. Unstrittig ist jedoch, die Therapierelevanz der hoch-schwelligen MET Amplifikation (MET high-level Amplifikation) sowie der Splice-Varianten im Exon 14 des MET-Gens. Letztere ist jedoch mit <1% ausgesprochen selten. Alle Veränderungen des MET-Gens können sowohl im Andeo- als auch im Plattenepithelkarzinom gefunden werden. Bei Vorliegen dieser Veränderungen besteht die Möglichkeit der Therapie mit einem MET-Inhibitor. Dies sollte stets im Rahmen von klinischen Studien erfolgen. Die Amplifikation der MET-Gens spielt weiterhin eine wichtige als primärer oder erworbener Resistenzfaktor auf eine Therapie mit EGFR-Inhibitoren bei Vorliegen einer EGFR-Mutation. Der Nachweis einer Amplifikation im MET-Gen und einer Mutation im EGFR-Gen macht die Kombination eines MET-Inhibitors mit einem EGFR-Inhibitor notwendig. Auch hier ist eine Therapie nur im Rahmen einer klinischen Studie sinnvoll und möglich. Informationen hierzu erhalten Sie von Ihrem behandelnden Arzt oder direkt von uns.
Aktivierende PIK3CA-Mutationen kommen sowohl im Plattenepithelkarzinom als auch im Adenokarzinom der Lunge mit einer Häufigkeit von etwa 4% vor. In vorklinischen Versuchen hat sich gezeigt, dass Mutationen im PIK3CA-Gen das Wachstum von Tumoren auslösen können. Die die Bedeutung von Mutationen dieses Gens im Lungenkrebs konnte noch nicht abschließend geklärt werden. Mutationen in diesem Gen können mittels Parallelsequenzierung identifiziert werden. Leider gibt es für Patienten deren Tumoren Mutationen im PIK3CA-Gen aufweisen noch keine zugelassenen zielgerichteten Medikamente. Inhibitoren des Proteins werden allerdings in einer Reihe von Studien erprobt und sind somit in bestimmten Fällen zugänglich.
Translokationen des Gens ROS1 im Lungenkrebs sind mit 1% sehr selten und kommen nur in Adenokarzinomen vor. ROS1-Translokationen können alleine zu einer zum Wachstum von Tumoren führen und kommen in der Regel nicht gleichzeitig mit Veränderungen in den Genen EGFR, ALK, RET und KRAS vor. Der genaue Mechanismus des Entartungspotentials von ROS1 konnte noch nicht endgültig geklärt werden. Wie auch Translokationen des ALK-Gens, kommen Translokationen von ROS1 fast ausschließlich bei Nierauchern vor. ROS1-Translokationen können routinemäßig mittels Fluoreszenz in-situ Hybridisierung (FISH) detektiert werden. Wie auch Tumoren mit Translokationen des ALK-Gens, sprechen Tumore mit ROS1-Translokationen sehr gut auf den Inhibitor Crizotinib (Xalkori) an. Dieses ist allerdings ausschließlich zur Anwendung in Patienten mit ALK-Translokationen zugelassen. Zugänglich sind zielgerichtet Therapien beim Vorliegen einer ROS1-Translokation allerdings in klinischen Studien, so zum Beispiel in der EUCROSS-Studie im NGM. Leider entwickeln Tumoren die zielgerichtet mit Crizotinib behandelt werden, ähnlich wie auch Tumore mit ALK-Translokationen und EGFR-Mutationen nach 1-2 Jahren der Therapie eine Resistenz. Die genauen Mechanismen der Resistenzentwicklung sind bis heute allerdings nicht vollständig bekannt. Die Entnahme von Tumorgewebe im Falle einer solchen Resistenz kann Aufschluss darüber geben ob Mechanismen vorliegen die mit zielgerichteten Medikamenten gebrochen werden können. Wenn Sie Fragen zur Therapie der ROS1-Translokation oder der Resistenzentwicklung haben, wenden Sie sich bitte an Ihren behandelnden Arzt oder direkt an uns.
HER-2, HRAS, RET, ALK, NRAS
Finden sich keine genetischen Veränderungen, liegt für das spezifische Gen ein Wildtyp vor (zum Beispiel EGFR Wildtyp bei Fehlen von Mutationen im EGFR-Gen). In dem Fall gibt es keine Möglichkeit einer zielgerichteten Therapie, da kein spezifischer Treiber gehemmt werden kann.
Last Update: